酸碱催化是催化化学中最普通和应用最为广泛的催化过程之一,在特定的条件下,酸碱功能的相互转化为人们设计特定的选择性催化反应提供了多种可以想象的空间。利用这一潜在的契机,中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室的研究人员,成功的实现了一类手性Brønsted酸催化的吲哚与α,β-不饱和γ-内酰胺的对映选择性N-H官能化新反应。
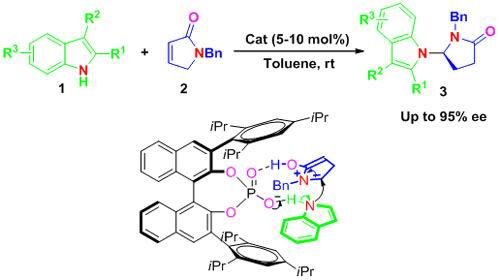
吲哚不对称N-H官能化反应
具有杂环结构的手性吲哚是一种非常重要的药效基团,大量存在于人工合成的具有生理活性的药物及天然产物中。因此,直接通过对映选择性活化吲哚中心合成具有光学活性的吲哚衍生物引起了科学家的广泛**************。而大量不对称烷基化反应都集中在吲哚类化合物的C2和C3原子上,吲哚N-H官能团的活化一直受到限制。一般吲哚N-H官能化只有在碱存在下通过拔去吲哚NH官能团上的质子才能实现。研究人员独辟蹊径,利用共轭酸碱的原理即在一定的条件下,酸可以发挥碱的功能,碱也可以发挥酸的功能的特性,采用手性Brønsted酸作为催化剂,巧妙地利用α,β-不饱和γ-内酰胺在酸性条件下能形成N-酰亚胺正离子而消耗酸性质子,失去质子的手性磷酸形成的共轭碱与吲哚N原子上的H原子形成氢键从而能够活化N-H键的策略,发展了一类新型的N-H官能化反应。基于手性磷酸的高效的手性诱导能力,促使吲哚作为亲核试剂选择性的进攻N-酰亚胺正离子的Re-面,从而高对映选择性的获得N-H官能化产物。研究人员通过原位红外光谱,高分辨质谱,氘代实验很好的阐述了该反应的反应机理。该类产物经过进一步的简单转化就可以获得具有潜在生理活性的多环类杂环化合物,可望用于新药的发现。该研究提供了一种用以简单起始原料合成具有高对映选择性的手性吲哚衍生物的新方法,同时该研究开启了手性Brønsted酸催化的吲哚分子的不对称N-H官能化新途径。
该研究工作得到了国家自然科学基金和中国科学院“百人计划”支持。研究结果在线发表于《应用化学》(Angew. Chem. Int. Ed.) 。(来源:中国科学院兰州化学物理研究所 张慧玲)